Modtagerne af Novo Nordisk Prisen 2022 og Nobelprisen 2023 i fysiologi og medicin fortæller her historien bag udviklingen: fiaskoerne, vedholdenheden og mistilliden til den teknologi, som, de nu er sikre på, også vil revolutionere tilgangen til behandling af mange ellers uhelbredelige sygdomme. Da verden blev låst inde på grund af COVID-19-pandemien, var der brug for et mirakel for at genåbne den. Vaccineforskere over hele verden smed, hvad de havde i hænderne, for at deltage i det kollektive kapløb mod den nye virus. Den over målstregen var en virkelig outsider: mRNA-vaccinen. De fleste ved dog ikke, at arbejdet med mRNA som en ny lægemiddelklasse startede for årtier siden.
Selvom det kan virke som en evighed, er der kun gået lidt over to år, siden de første rapporter om en ny virus fra Wuhan-provinsen i Kina nåede de globale medier. Læge og videnskabsmand Uğur Şahin, direktør for det tyske biotekselskab BioNTech, der udvikler kræftvacciner, fulgte med via tidsskriftet The Lancet, som skrev om de allerførste tilfælde af SARS-CoV-2. Det, han læste, skulle vise sig at vende op og ned på den verden, vi kender.
"Den beskrev mennesker uden symptomer, uden feber, der alligevel blev testet positive for SARS-CoV-2. Jeg forestillede mig virus som en kræftsygdom, der allerede ubemærket metastaserede. Først senere ser man, hvad der sker. Jeg så fly for mig lette fra Wuhan – fyldt med tilsyneladende raske mennesker, som først senere blev syge og begyndte at inficere andre. Jeg regnede på det og fandt frem til, at virus, der forårsagede udbruddet, allerede måtte have spredt sig over hele verden. Jeg var sikker: vi var nødt til at handle med det samme,” forklarer Uğur Şahin.
Hastighed skabte mistillid
Sammen med sin hustru, medstifter og Chief Medical Officer hos BioNTech, Özlem Türeci, besluttede Uğur Şahin at bruge en betydelig del af virksomhedens ressourcer fra deres igangværende udvikling af en cancervaccine for at udvikle en vaccine mod ny coronavirus så hurtigt som muligt.
“Vi kaldte det Project Lightspeed – for at gøre det klart, at de eneste begrænsninger, der ikke ville blive sat spørgsmålstegn ved, var fysikkens; alt andet ville blive udfordret,” forklarer Özlem Türeci.
Men af de 178 vaccinekandidater, som var med i vaccinekapløbet mod COVID-19, troede kun meget få mennesker, at Project Lightspeed ville vinde kapløbet. Meddelelsen i november 2020 om, at BioNTech og Pfizers mRNA (messenger RNA)-vaccine var 95 % effektiv mod COVID-19, var begyndelsen til enden på pandemien. Vaccinen skabte tro på, at der var lys for enden af tunnelen, men den skabte også mistillid til, hvordan den vaccineudvikling, som normalt tager år, nu kunne ske på mindre end et år.
"Hvad, mange mennesker rundt om i verden ikke vidste, var, at forskere over hele verden har arbejdet utrætteligt på at forstå og optimere dette lille molekyle. Et molekyle, som mange ikke anså for lovende, fordi det er for ustabilt, for svagt og inflammatorisk,” siger Özlem Türeci.
"Vi så skønheden ved mRNA og har brugt årtier på at finde måder at overvinde dets svagheder på. Da pandemien ramte, mente vi, at den her teknologi var en af de bedste muligheder for at overvinde pandemien i tide,” forklarer Uğur Şahin.
Livets stress
Succesen med mRNA-vaccinerne var heller ingen overraskelse for to andre pionerer bag udviklingen af mRNA-vacciner: den ungarske biokemiker Katalin Karikó, senior vice president hos BioNTech adjungeret professor ved University of Pennsylvania, og hendes amerikanske kollega Drew Weissman, professor i vaccineforskning på University of Pennsylvania, hvis forskningsresultater var en central del af grundlaget for Project Lightspeed, som de startede tre årtier før COVID-19 ramte.
"Da jeg startede min karriere, tænkte vi ikke på at stoppe pandemier. Vi tænkte på at lave nye vacciner. Før COVID-19 ramte, havde vi fem kliniske fase 1-forsøg med forskellige mRNA-vacciner, som vi arbejdede på. Og vi vidste på det tidspunkt, at denne teknologi havde potentialet til at blive en utrolig vaccine, men at se denne fænomenale succes er naturligvis overvældende,” forklarer Drew Weissman.
"Jeg havde aldrig drømt om, at min forskning ville have den her kæmpe betydning," fortæller Katalin Karikó.
Det var slet ikke indlysende, at Katalin Karikó overhovedet skulle blive forsker. Som datter af en slagter og en revisor voksede hun i 1950'erne og 1960'erne op i den lille by Kisújszállás i Ungarn. Naturvidenskaben fascinerede hende allerede i skolen, og "The Stress of Life", en bog af den ungarsk-canadiske endokrinolog Hans Selye, inspirerede hende især.
Især hans tese om, at den rigtige holdning kan forvandle negativ stress til positiv stress, viste sig at være meget vigtig for hendes videre karriere.
“Da jeg fortsatte som forsker, huskede jeg Selyes ord om fiasko og den rigtige holdning. Når en dør lukkes, åbnes en anden. Jeg ville ikke være, hvor jeg er i dag, uden alle de afvisninger og degraderinger, jeg har modtaget i løbet af min karriere. Så jeg bliver ikke vred på de her mennesker, der forsøgte at stoppe mig. Hvis du bliver skubbet til side, så bliver du skubbet til side. Men du skal alligevel bare blive ved med at forfølge din drøm,” husker Katalin Karikó.
Den mindre kendte fætter
Katalin Karikó har mødt masser af modstand på sin rejse. Hendes forskerkarriere begyndte på det biologiske forskningscenter i Szeged, Ungarn, hvor hun oprindeligt forsøgte at få celler til at optage liposomer – små stykker genetisk DNA indkapslet i små sfæriske strukturer – afgrænset af en membran bestående af fedtsyrer.
"Idéen var at få kroppen til at producere sin egen medicin til at bekæmpe mange sygdomme ved at bruge DNA-skabeloner, der blev transporteret ind med liposomerne," forklarer Katalin Karikó.
DNA blev dog senere erstattet af et andet nukleinsyremolekyle – dets dengang mindre kendte fætter, RNA. Begge molekyler er bygget op af lange kæder af fire nukleotidbaser: adenosin (A), cytidin (C) og guanosin (G) og derefter thymin (T) i DNA og uridin (U) i RNA.
"Rækkefølgen af nukleotidbogstaverne definerer den unikke genetiske kode for alle organismer. I celler findes gener, lavet af DNA, i kernen. Når disse DNA-originaler skal oversættes til proteiner, laves der små mRNA-kopier af de respektive DNA-originaler,” tilføjer Katalin Karikó.
RNA-kopierne bevæger sig derefter ud af kernen, hvor de omsættes til kroppens byggesten: proteiner.
"En fordel ved at bruge RNA i stedet for DNA er, at du ikke behøver at få RNA'et helt ind i cellekernen, og du roder ikke med originalerne – generne," siger Katalin Karikó.
De sidste penge proppet i en bamse
Da hun afsluttede sin ph.d.-grad, fortsatte Katalin Karikó som postdoc i Ungarn, men i 1985 mistede laboratoriet sin finansiering. Hun søgte job i Storbritannien, Spanien og Frankrig, men ingen ønskede at ansætte hende, da hun ikke kunne tage penge med fra Ungarn til sin forskning. Hun fik endelig et tilbud fra Robert Suhadolnik på Temple University i Philadelphia.
“Jeg var nødt til at forlade Ungarn med min mand og min 2-årige datter. Lovene var sådan, at vi ikke kunne komme afsted med mere end 100 USD i kontanter, så vi gemte vores sidste penge i hendes bamse – omkring 1.200 USD, som vi fik ved at sælge vores bil og veksle pengene på det sorte marked,” husker Katalin Karikó.
Robert Suhadolnik var interesseret i et lille molekyle bestående af tre identiske nukleotider. Det blev kaldt 2′,5′-oligoadenylat (2-5A), og Katalin havde arbejdet med det i Ungarn. Beviser indikerede, at 2-5A kunne igangsætte en immunreaktion, når dobbeltstrenget RNA leveres ind i cellerne. Forskerne håbede, at dette ville skabe en antiviral reaktion på den globale epidemi i 1980'erne: HIV.
"Det var de tidlige kliniske forsøg med dobbeltstrenget RNA, og vi offentliggjorde resultaterne i et prestigefyldt tidsskrift, The Lancet, i 1987, men desværre viste det sig, at en sådan terapi ikke hjalp mennesker, der var smittet med HIV," siger Katalin Karikó.

Katalin Karikó med sin mand Béla Francia og deres 2,5 år gamle datter Susan i september 1985 med deres første bil en måned efter deres ankomst til USA.
Ingen ønskede at yde støtte
Mange andre prøvede kræfter med DNA- og RNA-terapi, og de fleste mislykkedes totalt. Philip Felgners laboratorium ved University of Wisconsin-Madison i USA fik protein udtrykt i 1990 ved at injicere RNA og DNA i muskelceller fra mus. I 1993 indkapslede Martinon, Meulien og nogle kolleger i Frankrig mRNA i liposomer og injicerede dem i mus, hvilket fremkaldte et immunrespons mod influenzavirusproteinet kodet af mRNA.
"Problemet var imidlertid stabiliteten af RNA-molekylerne. I laboratoriet blev de hyppigt nedbrudt af andre enzymer, ribonukleaser, og ingen kunne finde ud af, hvordan det nogensinde skulle blive muligt at opbevare RNA som medicin på en hylde. Derudover havde vi ingen idé om, hvordan vi skulle få RNA'et til den rigtige celle og få cellen til at producere nok protein fra RNA'et,” forklarer Katalin Karikó.
I de næste 10 år levede Katalin et turbulent forskningsliv. Hun var postdoc ved Uniformed Services University of the Health Sciences i Bethesda, Maryland og derefter som forskningsassistent ved University of Pennsylvania i Philadelphia.
"Ligesom jeg troede, at jeg var på vej til at blive professor, blev mine ansøgninger om forskningsstøtte alle afvist, og i stedet blev jeg derfor degraderet af universitetet i 1995. Ingen troede rigtigt på, at RNA nogensinde ville fungere som et terapeutisk molekyle," siger Katalin Karikó.
Kopimaskine-møde
Der var kun nogle få mennesker undervejs, som anerkendte Katalin Karikós vision og hårde arbejde og talte hendes sag. Elliot Barnathan, en kardiolog, fortsatte med at tro på Katalin Karikós ideer og holdt hende på lønningslisten til sin forskning om forbedring af blodkartransplantationer. Da han forlod University of Pennsylvania, overtalte han neurokirurg David Langer til, at de havde brug for en molekylærbiolog.
Katalin Karikós karriere fortsatte på lånt tid, indtil hun en dag i 1998 stødte ind i en ny kollega ved afdelingens kopimaskine. Før videnskabelige tidsskrifter gik online, kopierede forskere nemlig artikler for at følge med i den seneste udvikling.
"Jeg så ham den nye henne ved kopimaskinen. Han fortalte mig, at han først for nylig var kommet til University of Pennsylvania og ønskede at udvikle en HIV-vaccine, der enten kunne helbrede HIV eller forhindre HIV-overførsel,” husker Katalin Karikó.
De to forskere indså hurtigt, at de delte en særlig interesse.
"Jeg havde altid ønsket at teste mRNA til mine vacciner," forklarer Drew Weissman, "og pludselig fortalte en person ved kopimaskinen mig, at det præcis var det, hun kunne. Det blev starten på et fantastisk samarbejde, der har varet lige siden.”
Dedikation og passion
Ud over RNA delte Katalin Karikó og Drew Weissman deres enorme dedikation og passion for videnskab, en passion som Drew har haft siden barndommen og som førte ham gennem en master i biokemi på rekordtid fra Brandeis University i 1981.
Han uddannede sig derefter som læge ved Boston University School of Medicine, fordi han mente, at det ville gøre ham til en endnu bedre forsker. Han modtog nu et stipendium fra United States National Institutes of Health, ledet af den nuværende direktør for National Institute of Allergy and Infectious Diseases, Anthony Fauci.
"Internettet eksisterede endnu ikke, så folk fra hele verden sendte spørgsmål til laboratoriet om sygdomme og diagnoser," fortæller Drew Weissman.
Opholdet i Anthony Faucis laboratorium gav ham derfor en helt ny forståelse af sammenhængen mellem at arbejde i et laboratorium og virkelige menneskers sundhed.
"Jeg blev dybt fascineret af immunsystemet og især den nye opdagelse af dendritiske celler, som rejser rundt i kroppen og forgrener sig som træer med fangarme, der kan strække sig og trække sig tilbage igen, og som er i konstant søgen efter fremmede organismer," uddyber han.
De dendritiske celler så dermed ud til at være nøglen til, hvordan immunsystemet kunne lære at besejre fremmede patogener som bakterier og virus.
"Udover at være enormt dynamiske er disse celler de mest potente antigen-præsenterende celler i immunsystemet. De fanger fremmedlegemer i kroppen og præsenterer dele af det fremmede stof på overfladen af cellerne og kommunikerer på den måde til de andre immunceller, såsom T-cellerne, hvad de skal ødelægge,” forklarer Drew Weissman.

Katalin Karikó og Drew Weissman fejrer med deres studerende og teknikere, at David Scale (anden fra højre) er optaget på Yales MD PhD-program.
Fiasko med potentiale
Da de dendritiske celler er kroppens primære antigen-præsenterende celler, er de også nøglen til effektiv vaccination. Katalin Karikó vidste ikke meget om dendritiske celler, da hun mødte Drew Weissman. Men hun kunne hjælpe ham med at teste mRNA'et af i cellerne. Katalin bragte sit syntetiske mRNA til laboratoriet, og Drew injicerede det i mus.
"Vi havde kodet vores mRNA-molekyler, så de ville producere et af nøglemålene til at bekæmpe HIV – et polyprotein kaldet Gag, der indeholder alle vigtige HIV-proteiner. Derefter indsatte vi RNA'et i de dendritiske celler og afventede spændt, hvad der skete, når de dendritiske celler blev sprøjtet ind i en mus. Resultaterne var meget positive, fordi vi fik et meget stærkt immunrespons,” siger Drew Weissman.
Katalin Karikó og Drew Weissman reagerede dog noget forskelligt på resultaterne. Ud over at aktivere immunsystemets T-celler, turboladede mRNA'et nemlig uafhængigt immunsystemet.
"Resultaterne var uventede og skuffende. Det leverede mRNA fremkaldte et voldsomt inflammatorisk og for musene dødeligt respons,” husker Katalin Karikó.
"Katalin var skuffet, fordi det betød, at mRNA ikke, som hun gerne ville, kunne bruges som en ren terapi, hvor man kodede en celle til at producere et protein, kroppen har brug for. Omvendt kunne jeg se et enormt potentiale, fordi mRNA skabte et så ekstraordinært stærkt immunrespons, som var helt afgørende i udviklingen af en vaccine. Så der, hvor Katalin så en fiasko, så jeg et potentiale,” forklarer Drew Weissman.
Under immunsystemets radar
Katalin Karikó og Drew Weissman brugte de næste par år på at undersøge årsagen til det kraftige immunrespons og forsøge at modificere det kunstige RNA, så det naturlige immunrespons af kunstigt produceret mRNA – om nødvendigt – kunne kontrolleres.
"Vi testede immunresponset på forskellige typer RNA-molekyler og fandt ud af, at transfer-RNA (tRNA)-molekyler - i modsætning til mRNA ikke inducerede nogen immunreaktion," siger Drew Weissman.
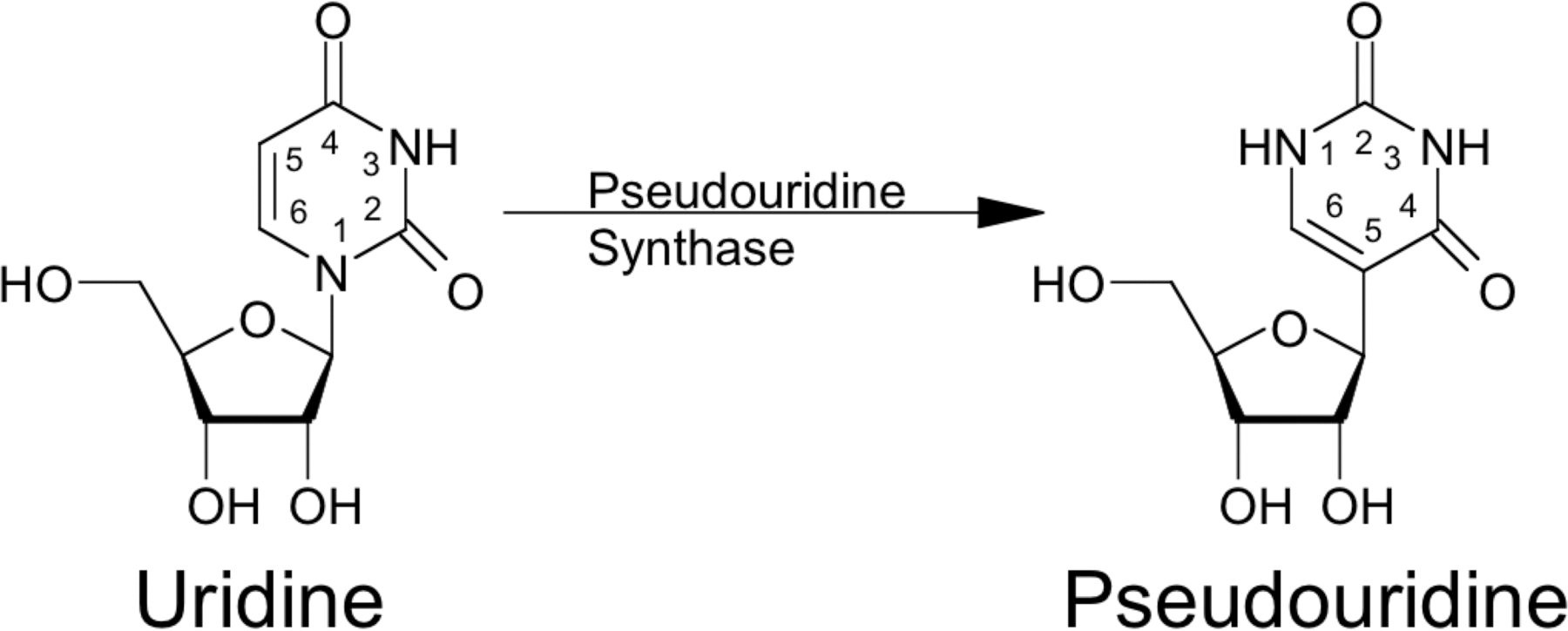
I lighed med DNA omfatter RNA rækker af fire nukleosider: adenosin (A), cytidin (C), guanosin (G) og uridin (U). Men i tRNA-molekyler er flere uridiner modificeret til pseudouridiner.
”Da vi lavede den samme ændring i mRNA, så vi pludselig den samme effekt. Molekylerne fløj under immunsystemets radar, så de kunne trænge ind i cellerne uden at advare kroppens forsvar. Molekylerne ændrede sig fra at være dødelige for musene til at være harmløse,” husker Drew Weissman.
En dør lukkes
Vejen var nu endelig klar for Drew Weissman og Katalin Karikó til at kaste sig ud i at udvikle både mRNA-vacciner og behandlinger mod sygdomme som hæmofili og Fabrys sygdom, hvor et manglende eller defekt protein skal erstattes. De oprettede derfor spin-out-virksomheden RNARx for at udvikle mRNA.
Katalin Karikó og Drew Weissman forbedrede deres teknologi yderligere, så de i 2012 brugte mRNA til at få mus til at øge deres produktion af erythropoietin (EPO) til behandling af anæmi.
"Vi valgte EPO-kodende mRNA, da det var ligetil at demonstrere effekten af EPO på produktionen af røde blodlegemer. Med en enkelt injektion på 100 nanogram EPO-kodende mRNA steg mængden af EPO markant efter blot 6 timer og forblev høj i 4 dage. Så vi troede, at det havde potentiale til klinisk anvendelse,” forklarer Katalin Karikó.
Det endte dog med, at Katalin Karikó og Drew Weissman ikke kunne få licensen til deres firma.
"Universitetet endte med at sælge eksklusive patentrettigheder til en laboratoriereagensleverandør, CELLSCRIPT, for 300.000 USD. Det var begyndelsen på enden for RNARx, som vi var nødt til at lukke i 2013, men som sædvanligt, når en dør lukkes, åbner en anden som regel,” uddyber Drew Weissman.

Uğur Şahin og Katalin Karikó mødtes første gang i 2013: mRNA-samfundet var småt og godt sammentømret. Şahin var interesseret i Karikós og Weissmanns videnskabelige arbejde og inviterede Karikó til at holde en forelæsning på University Medical Center ved Johannes Gutenberg-University Mainz, Tyskland.
Samme problem – anden løsning
En ny dør åbnede sig i hovedkvarteret i Mainz, hvor en anden forskergruppe havde arbejdet på mRNA og immunterapier i mere end 20 år. Deres veje krydsedes tilbage i 2013, da Uğur Şahin, CEO for BioNTech, inviterede Katalin Karikó til at holde et foredrag i Mainz, Tyskland om hendes teknologi til fremstilling af ikke-inflammatorisk mRNA.
"Jeg var interesseret i deres teknik, fordi de havde fundet helt forskellige måder at løse de samme svagheder ved mRNA, da det endnu ikke var tilstrækkelig potent til at producere protein nok," forklarer Uğur Şahin.
På trods af, at de befandt sig på forskellige sider af Atlanten og ikke var i direkte samarbejde eller kontakt, så forskerne ud til at være på vej til at løse de samme problemer på samme tid – på forskellige måder.
"Vores løsning fjernede ikke den naturlige inflammatoriske kraft af mRNA, som vi mente var afgørende for vores kræftvaccine. Jeg var derfor nysgerrig efter at forstå mere om den ikke-inflammatoriske mRNA-tilgang og se, om vi kunne arbejde sammen om yderligere at optimere mRNA-terapi. Jeg inviterede derfor Katalin til at holde et foredrag hos os i Mainz og vi begyndte heldigvis at samarbejde,” fortæller Uğur Şahin.
"Uğur og Özlem kendte mit arbejde omkring RNA, og jeg kendte deres arbejde. Min far var slagter, og Uğurs far var fabriksarbejder. Der var kun få forskere dengang der arbejdede med mRNA, og vi kendte hinandens publikationer godt. Derudover var vi alle immigranter og arbejdede på det samme upopulære molekyle. Det klikkede mellem os med det samme,” forklarer Katalin Karikó.
Lidt ligesom i en Hollywood-film
Uğur Şahins familie er fra Tyrkiet, men flyttede til Tyskland i 1969, da Uğur Şahin var 4 år gammel. Han voksede op i Köln og studerede medicin på universitetet i Köln.
"Jeg brændte for matematik og naturvidenskab som ung. Jeg var i den katolske kirkes bibliotek hver weekend. Bibliotekaren lagde nye videnskabelige bøger og populærvidenskabelige tidsskrifter til side til mig,” husker Uğur Şahin.
Hans interesse for at bekæmpe kræft gennem kroppens immunsystem blev vakt som gymnasieelev, da en pårørende udviklede kræft.
"Efter endt uddannelse blev jeg ansat som læge til at behandle kræftpatienter på Saarland University Medical Center, og det var der, jeg mødte Özlem," fortæller Uğur Şahin.
Özlem Türeci voksede op i Tyskland som datter af en biolog og en læge, der kom fra Tyrkiet. Det var dog nonnerne på hendes fars hospital, der inspirerede Özlem Türeci.
"Jeg var seks eller syv år gammel, da min far gav mig lov til at se den første operation i mit liv. Jeg vidste bare, at jeg ville lave det samme,” husker hun.
Ligesom hendes far og nonnerne ville hun hjælpe mennesker i nød og besluttede sig derfor for at læse medicin på universitetet i Saarland. Uğur Şahin og Özlem Türeci endte med at arbejde på samme hospitalsafdeling, og de brugte begge deres fritid i laboratoriet på at forske i nye måder at stimulere immunforsvaret mod kræft.
"Uğur og jeg behandlede begge mennesker med kræft. Vi er også begge immunologer og mødtes på hospitalet under vores vagter. Det var lidt ligesom i en Hollywood-film. Vi forelskede os i mRNA og hinanden,” tilføjer Özlem Türeci.
Personlige vacciner
I løbet af dagen arbejdede de tæt sammen om at behandle kræftpatienter så godt, som de kunne, og diskuterede patienternes medicinske behov.
”Vi stillede tidligt os selv spørgsmålet: hvordan kan vi som læger overhovedet opfylde medicinske behov, når den nuværende standard for behandling til mennesker med kræft ikke er bedre? Tidligt begyndte vi derfor at arbejde i laboratorierne om aftenen og i weekenden for at finde bedre måder at behandle kræft på,” forklarer Özlem Türeci.
Uğur Şahin og Özlem Türecis vej til mRNA-terapi begyndte i kræftforskningen i midten af 1990'erne. De fokuserede på at udvikle individualiserede cancervacciner ved at booste en patients immunsystem mod antigenerne fra patientens egen tumor for at stimulere en mere målspecifik ødelæggelse.
"Vi vidste, at hver patients tumor er unik, hvilket førte os til den konklusion, at hver behandling skulle skræddersyes til denne patients tumor," siger Uğur Şahin.
"Vi holdt derfor fast i ideen om, at aktivering af immunsystemet, gennem en vaccine, kunne skabe fremtidens kræftbehandling," tilføjer Özlem Türeci.
For at udvikle en ny mRNA-baseret kræftbehandling, der adresserede dette problem, stod Uğur Şahin og Özlem Türeci over for tre store udfordringer, som blev betragtet som uoverkommelige på det tidspunkt.
"For det første var mRNA stadig ikke potent nok til at blive brugt mod mange sygdomme som fx kræft. Selv ganske små tumorer består af milliarder af kræftceller. For at bekæmpe denne overflod af kræftceller, skal vaccinen være ekstraordinært effektiv og kunne generere milliarder af immunceller,” forklarer Özlem Türeci.
Yderligere er de tumorkarakteristika, der genkendes af immunsystemet, forskellige for hver enkelt patient. Uğur Şahin og Özlem Türeci erkendte, at en individualiseret vaccineteknologi var nødvendig for at skræddersy vacciner til hver patients antigenprofil.
"Vigtigst var det, at individualiserede vacciner skulle produceres meget hurtigt, så de kunne gives rettidigt til patienter, der ventede på behandling, før kræften spredte sig yderligere," forklarer Özlem Türeci.
Iværksættere ud af desperation
Kræftimmunterapi er det felt, hvor forskning i mRNA-baserede teknologier har eksisteret længst. Allerede i 1995 viste forskere fra David Curiels gruppe ved University of Alabama i Birmingham, at injektion af mRNA, der koder for en tumormarkør, kunne fremkalde et antistofrespons.
"Kortlægningen af de antigen-mål, der skal vælges til en given immunterapi, viste, at ét mål ikke kunne identificeres for hver type cancer, og at de samme targets ikke engang findes blandt forskellige patienter med samme type cancer. Sådan opstod vores vision om individualiseret kræftbehandling,” siger Özlem Türeci.
Gensekventering var dog stadig langsom og dyr i 1990'erne, og ligesom Katalin Karikó og Drew Weissman fandt Uğur Şahin og Özlem Türeci ud af, at de tidlige lovende resultater med mRNA-terapi ikke førte til større finansiering eller investeringer. I stedet fulgte kræftforskere i årene efter terapeutiske tilgange baseret på DNA og proteiner.
"Vi blev iværksættere af desperation, fordi vi lærte, at der skal meget mere til end blot opdagelsen for at transformere videnskab til bedre overlevelse for kræftramte," husker Özlem Türeci og forklarer, hvorfor hun først blev læge, derefter forsker og siden iværksætter i 2001.

I 1999 var Uğur Şahin og Özlem Türeci immunologer ved det samme hospital i Tyskland, hvor de om dagen behandlede patienter med kræft og om aftenen forskede i at finde bedre måder at kurere kræft på. De blev forelskede i mRNA og hinanden.
For tidligt, for risikabelt, for svært
I 2001 grundlagde Özlem Türeci og Uğur Şahin derfor deres første selskab, Ganymed Pharmaceuticals, sammen med deres mentor Christoph Huber, som transformerede grundforskning til en ny klasse af kræftlægemidler, som de kaldte ideelle monoklonale antistoffer, der udelukkende binder til overfladen af patientens kræftceller.
Özlem Türeci blev CEO og Uğur Şahin forskningschef. Men selvom Ganymed Pharmaceuticals blev en videnskabelig stor succes, var de nødt til at sælge virksomheden, fordi de ikke havde råd til det store fase 3-forsøg til at udvikle antistoffet til markedsgodkendelse.
”Vi måtte lære, at forskning alene ikke kunne nå patienterne. Der kræves store forsøg og finansiering for at skabe og i sidste ende udrulle en ny medicin, så den ideelt set kan nå millioner eller milliarder af mennesker verden over,” forklarer Özlem Türeci.
Og adgang til finansiering af mRNA var ikke let efter finanskrisen i 2008.
"For tidligt, for risikabelt, for svært – det var de reaktioner, vi hørte meget. Da vi præsenterede vores vision for den typiske biotekinvestor, var svaret næsten altid, at mRNA-baserede skræddersyede vacciner er en god idé, men aldrig vil fungere,” siger Özlem Türeci.
Højt og tydeligt
Heldigvis kunne Uğur Şahin og Özlem Türeci overbevise en håndfuld private investorer, der har troet på deres vision lige fra begyndelsen. Blandt dem var to tyske investorer: Strüngmann-brødrene, der grundlagde Hexal og investerede 180 millioner USD i BioNTech i 2007 efter salget af virksomheden.
"De gik med til en klausul uden spørgsmål og at afgive retten til at tvinge et salg igennem i de første 15 år. Dette gav os rum til at realisere vores vision og de mål, vi havde sat os som unge læger 13 år tidligere,” husker Özlem Türeci.
Med støtten kunne Özlem Türeci og Uğur Şahin nu udvikle og producere individualiserede og innovative immunterapier mod kræft, herunder deres drøm om mRNA-vacciner. Allerede i slutningen af 1990'erne havde de påbegyndt en systematisk opdagelses- og optimeringsproces for at løse de grundlæggende problemer ved RNA: lav og kortvarig proteinproduktion.
"Vi besluttede at fokusere på de ikke-proteinkodende strukturelle komponenter i mRNA, inklusive cap-regionen, som hjælper med at eksportere mRNA til cellecytoplasmaet, og poly-A halen, som hjælper med at binde til ribosomet, hvor oversættelsen til protein finder sted,” forklarer Uğur Şahin.
Øget med flere tusinde gange
Hver af disse komponenter beskytter mRNA'et mod nedbrydning og har dermed indflydelse på, om og hvor meget mRNA, der oversættes til protein, hvor længe det er aktivt, og hvor hurtigt det nedbrydes. Uğur Şahin og Özlem Türeci opdagede modifikationer i cap-delen, poly-A halen og andre områder af mRNA, der ikke ovrersættes til protein. Kombinationen af modifikationer resulterede i en eksponentiel forbedring af styrken af mRNA-molekylerne.
"Vi lavede disse ændringer af mRNA-rygraden ikke kun for at forbedre stabiliteten af molekylet, så det ikke nedbrydes så hurtigt, men også for at øge mængden af protein, der produceres inde i cellen. Vi havde således fundet en måde at kommunikere højt og tydeligt med immunsystemet og fortælle det, hvad det skulle angribe,” siger Uğur Şahin.
Deres gennembrud blev offentliggjort i det peer-reviewede tidsskrift Blood i 2006, efterfulgt af en række artikler i årene 2007 til 2010, der beskriver yderligere forbedringer af mRNA-rygraden.
"Kombinationen af disse optimerede komponenter øgede det mRNA-inducerede antigenudbytte flere tusinde gange, så dette fik os virkelig til at tro, at det nu var kraftigt nok til at blive brugt mod både kræft og infektionssygdomme," forklarer Uğur Şahin.
De systematiske principper for mRNA-vaccinedesign introduceret af Uğur Şahin og Özlem Türeci blev den nye standard til optimering af stilladser til mRNA-terapi. Det var også det første skridt i udviklingen af den første mRNA-baserede vaccine i medicinhistorien.
"På denne måde var en lille mængde mRNA i stand til at inducere immunresponser stærke nok til at se tumorer skrumpe hos nogle af vores patienter i de kliniske forsøg," forklarer Özlem Türeci.
Uğur Şahin og Özlem Türeci begyndte i 2010 at søge efter den rette blanding af lipider, der kunne hjælpe med at skabe små bobler til at beskytte mRNA'et mod nedbrydning i kroppen og sikre, at det nåede frem til lymfeknuderne og milten. På næsten samme tid på den anden side af Atlanten testede Drew Weissman, Katalin Karikó og deres kolleger uafhængigt andre typer af lipidbobler i nanostørrelse.
Bobler i nanostørrelse
mRNA-forskningen havde nu gjort store fremskridt på begge sider af Atlanten. Et væsentligt problem manglede dog stadig at blive løst: RNA'et skulle målrettes det rigtige sted. Men hvad var det rigtige sted? I langt de fleste undersøgelser blev mRNA sprøjtet ind i huden eller i musklen.
Men ligesom Drew Weissman og Katalin Karikó mente Uğur Şahin og Özlem Türeci, at mRNA skal nå de mest centrale celler af immunsystemet, de dendritiske celler i lymfeknuderne og milten.
"Vores første eksperiment, hvor vi injicerede mRNA i lymfeknuden, var en ægte game-changer. En morgen sad vi alle sammen ved skærmen, der var tilsluttet immuncelle-måleapparatet, og da vi så styrken af immunresponset, faldt vi næsten ned af vores stole,” siger Uğur Şahin.
Den mRNA-vaccine, der blev injiceret i lymfeknuden, havde udløst et immunrespons, der var dramatisk stærkere end det mRNA, der blev injiceret i huden eller musklen.
”Vi forstod med det samme, at dette var en afgørende del af løsningen. Vi var nødt til at finde en måde at få mRNA-vaccinen ind i lymfeknuderne,” forklarer Uğur Şahin.
Opfør dig som et postnummer
Uğur Şahin og Özlem Türeci begyndte i 2010 at søge efter den rette blanding af lipider – fedtstoffer – der kunne hjælpe med at skabe små bobler til at beskytte mRNA'et mod nedbrydning i kroppen og sikre, at det nåede frem til lymfeknuderne og milten.
"I forsøgene brugte vi mRNA, der samtidigt kodede for proteiner, der udsender lys, så vi kunne undersøge, hvilke organer der lyste op, efter vi havde givet mRNA'et i de forskellige blandinger af lipider," forklarer Uğur Şahin.
To år senere havde Uğur Şahin og Özlem Türeci fundet den rette blanding lipidnanopartikel. Det fungerede næsten ligesom et postnummer, så den givne mRNA-vaccine blev leveret til rette celler – i dette tilfælde de dendritiske celler i lymfevæv over hele kroppen, hvor den kunne omsættes til protein.
"Det gjorde det muligt at målrette et stort antal dendritiske celler for at skabe en stor immuncellehær, der præcist genkendte kræftcellerne – og kun kræftcellerne. Resultaterne var imponerende,” husker Uğur Şahin.
Men ingen havde tidligere undersøgt lipidnanopartiklerne hos mennesker. I 2 år måtte Uğur Şahin og Özlem Türecis team hos BioNTech arbejde hårdt for at skabe lipiderne i klinisk kvalitet og vente tålmodigt på resultaterne af et klinisk forsøg blandt kræftpatienter, der blev offentliggjort i en banebrydende artikel i Nature.
"De kliniske data overbeviste os virkelig i sidste ende. Behandlingen var sikker, og selv hos patienter, der blev behandlet med den laveste dosis på kun 14 µg, så vi et ekstremt stærkt immunrespons,” husker Özlem Türeci.
Et spørgsmål om balance
I mellemtiden på den anden side af Atlanten testede Drew Weissman, Katalin Karikó og deres kolleger uafhængigt andre typer af lipidbobler i nanostørrelse som mRNA-bærere i 2015. I samarbejde med et forskerhold ved University of British Columbia i Vancouver, Canada, fik de leveren til at producere et lysende protein, som deres mRNA havde kodet for – over en længere periode på 10 dage. Igen fandt de amerikanske og tyske hold – uafhængigt af hinanden – forskellige løsninger til at løse de samme udfordringer.
”Vi udviklede metoder til at gøre mRNA'et immunologisk tavst, hvorimod Uğur og Özlem brugte naturligt RNA til at aktivere de immunresponser, der kan booste effekten af en vaccine. I stedet konstruerede vi lipidboblerne, så de i sig selv boostede et immunrespons. Det mest fantastiske ved disse nanolipider er, at man ændrer lidt på overfladerne, så man kan målrette dem til helt andre steder i kroppen,” forklarer Drew Weissman.
I 2015, efter 30 års forskningsindsats, forstod de fire mRNA-musketerer klart, at det er et spørgsmål om balance at få RNA-terapi til at fungere.
”RNA er ustabilt, hvilket er et problem, men ustabiliteten er også en fordel, da de – som med andre gode lægemidler – så nedbrydes relativt hurtigt i kroppen, så de ikke får en varig og måske ødelæggende effekt. Så det er bedre at bruge mange kopier af en mRNA-medicin, der nedbrydes hurtigt, end én kopi af DNA, der kan ændre genomet permanent,” tilføjer Drew Weissman.
Det er også et spørgsmål om balance vedrørende immunogeniciteten.
”På den ene side har man brug for en vaccine, der booster immunforsvaret. På den anden side må immunresponset ikke være for stærkt,” forklarer Drew Weissman.

Drew Weissman og Katalin Karikó på University of Pennsylvania i 2015.
Eftersøgt – død
Bevæbnet med denne information kunne forskerne nu for alvor drømme om at begynde at behandle og helbrede mennesker med sygdomme, som tidligere havde været svære, hvis ikke umulige at behandle. Allerede i 2014 behandlede Özlem Türeci og Uğur Şahin og deres kolleger den første patient med en on-demand-fremstillet mRNA-vaccine, der kodede for de unikke mutationer i tumorprøven fra den enkelte patient.
"Når de dendritiske celler optager RNA'et, producerer de små kopier af mutationerne, som er karakteristiske træk ved denne patients cancer, som sendes til overfladen af cellen og genkendes af immuncellerne. Dermed vil kroppen vide, hvordan man identificerer de kræftceller, der skal ødelægges,” siger Özlem Türeci.
Hun sammenligner det at give mRNA-beskeder til immunsystemet med at give en sherif en plakat af en eftersøgt skurk. Portrættet skal være så nøjagtigt som muligt. Hvis plakaten er unøjagtig, kan sheriffen (immunsystemet) muligvis ikke genkende målet, og endnu værre, angribe og ødelægge det forkerte mål.
"I vores første individualiserede mRNA-kræftvaccineforsøg skræddersyede vi mRNA-vacciner til 13 personer med metastatisk melanom, en kræfttype med en høj frekvens af mutationer. Vi skabte et markant immunrespons i flere måneder, så det fik os til for alvor at tro, at vores drøm om at udvikle personlige kræftvacciner kunne lykkes,” husker Özlem Türeci.
Profetisk
Drømmen om mRNA-vacciner fik yderligere kraft i de følgende år. I 2017 offentliggjorde BioNTech-medstifterne og deres team undersøgelsesresultater i Nature om deres succesfulde udvikling af individualiserede mRNA-baserede vacciner og det stærke immunrespons, de var i stand til at inducere hos cancerpatienter.
"Vi havde nu optimeret designet og fremstillingsprocessen af mRNA-baserede behandlinger så meget, at vi nu kunne skræddersy en vaccine til et specifikt mål inden for få uger," forklarer Uğur Şahin.
Samme år offentliggjorde Drew Weissman og kolleger, herunder Katalin Karikó, et præklinisk studie, hvor de producerede en vaccine mod Zika-virussen gennem mRNA formuleret med lipid-nanopartikler, ligesom der blev påbegyndt kliniske undersøgelser af mRNA-vacciner mod rabies og influenza.
Resultaterne var så opmuntrende, at Uğur Şahin kom med en dristig forudsigelse på en konference i Berlin i 2018. I et lokale fyldt med eksperter inden for infektionssygdomme annoncerede han, at hans virksomhed i tilfælde af en global pandemi ville bruge mRNA-teknologi til hurtigt at udvikle en vaccine, og at en mRNA-vaccine kunne tilpasses til regionalt forekommende varianter i tilfælde af en infektionssygdom, der spreder sig globalt.

Ugur Sahin præsenterer konceptet med individualiserede mRNA-baserede vacciner til at tackle globale sundhedstrusler ved Grand Challenges Meeting i Berlin, Tyskland, i 2018.
Ring igen om et par uger
Et år efter Uğur Şahins udtalelse tikkede de første rapporter om en ny coronavirus fra Kina ind.
"Artiklen i The Lancet den 24. januar 2020 overbeviste os om, at en pandemi var på vej, og at vi burde handle, uanset risikoen for vores virksomhed," forklarer Uğur Şahin.
Artiklen, skrevet af forskere i Kina, gav det første stærke bevis for, at det virus, der senere blev kaldt SARS-CoV-2, kunne overføres mellem mennesker, men noget andet sendte et gys igennem Uğur Şahin: en 7-årig pige blev testet positiv for SARS-CoV-2 – uden at vise symptomer.
Uğur Şahin og Özlem Türeci overbeviste bestyrelsen for BioNTech om, at de burde reagere, og få dage efter den genetiske sekvens af SARS-CoV-2 blev offentliggjort, havde BioNTech udstukket en ny kurs. BioNTechs senere partner, Pfizer, var dog ikke overbevist om, at den skulle med i projektet.
Pfizers Vice President og Chief Scientific Officer, Phil Dormitzer, afviste oprindeligt tilbuddet om at udvikle en COVID-19-vaccine, fordi han ligesom mange andre troede, at SARS-CoV-2, ligesom SARS-pandemien i 2003 og MERS-pandemien i 2012, ville gå i sig selv.
"Efter telefonopkaldet med Phil sagde jeg til Özlem: 'Vi ringer bare til ham igen om et par uger'," husker Uğur Şahin.
Med lysets hastighed
Uğur Şahin og Özlem Türeci holdt ud, og næste gang, Uğur Şahin ringede til Pfizer, var COVID-19 begyndt at forårsage mange dødsfald – også i USA. Pfizer sagde ja.
I de næste 9 måneder brugte forskerne derefter mere end 30 års erfaring med at udvikle mRNA-vacciner i Project Lightspeed.
Uğur Şahin og Özlem Türeci skabte vaccine BNT162b2 ved at producere kunstigt mRNA og indkapsle det i lipid-nanopartikler. Når de injiceres i kroppen, rejser de små mRNA-fyldte nanopartikler mod lymfevævet, hvor de optages af dendritiske celler.
"De dendritiske celler i lymfeknuderne nær injektionsstedet optager de bittesmå partikler og producerer derefter kopier af SARS-CoV-2 spikeprotein og sender de små plakater af skurken til overfladen af cellerne. De dendritiske celler fungerer på den måde som en slags generaler, der træner specialiserede celler i immunsystemet til at dræbe skurken,” forklarer Özlem Türeci.
Men selvom forskerne var sikre på, at teknologien ville virke, var mange mennesker ikke overbeviste.
"Selvom Moderna havde udført kliniske forsøg, der beviste sikkerheden af mRNA-vaccineteknologien, var vi nødt til at lave vores egne sikkerhedsundersøgelser, før vi kunne gå ind i kliniske undersøgelser i fase 3, der involverede mennesker. Vores teams arbejdede dag og nat; arbejdsgange, der normalt skete sekventielt, blev nu sat i gang parallelt,” husker Özlem Türeci.
"Den dag i november 2020, hvor analysen af vores fase 3-studier blev udført, var virkelig regnskabets dag."
Margaret Keenan, 91, var den første person i verden, der fik en klinisk godkendt COVID-19-vaccine på universitetshospitalet den 8. december 2020.
Dybt berørt af bogstaverne
Den 9. december 2020 fik Uğur Şahin et opkald fra CEO for Pfizer, Albert Bourla.
"'Vil du kende resultatet?', spurgte Albert. Jeg sagde 'nej'. En virkelig dårlig joke, og de næste par sekunder føltes som en evighed, indtil han sagde 'Det virker'," husker Uğur Şahin.
Resultaterne af fase 3-forsøgene blev offentliggjort dagen efter. Vaccinen var 95 % effektiv mod COVID-19. Meget få mennesker havde forudsagt, at mRNA-vaccinerne fra BioNTech/Pfizer og Moderna ville være de første og mest succesrige til at bremse COVID-19-pandemien. Hverken succesen eller manglen på tro på mRNA-vaccinernes succes overraskede dog de fire forskere.
”Jeg var selvfølgelig meget glad, men jeg forventede det faktisk også. Tidligere kliniske forsøg havde allerede vist, hvor effektive mRNA-vacciner var mod andre infektionssygdomme såsom influenza. Jeg var dog stadig ligeså dybt rørt over de breve, folk sendte til mig, der fortalte mig, hvad vaccinen betød for dem. De kunne igen besøge deres elskede familie,” siger Katalin Karikó.
Ved udgangen af januar 2022 var 10 milliarder COVID-19-vaccinationer blevet givet, og i november 2021 vurderede WHO, at vaccinerne direkte havde reddet 500.000 liv.
"Det skøn inkluderer ikke engang liv, der er reddet fra den indirekte effekt af vaccination, der reducerer infektionsraten, så sundhedssystemernes kapacitet kan følge med, mens de venter på, at en mindre dødelig variant af SARS-CoV-2 dukker op," tilføjer Katalin Karikó.
En vaccine mod Omikron-varianten med den sædvanlige mRNA-vaccineeffektivitet er allerede blevet fremstillet og testes i kliniske forsøg. Det er ved at blive rullet ud, kun måneder efter Omikron dukkede op. Ifølge Özlem Türeci er det endnu for tidligt at fastslå, hvornår kampen mod pandemien slutter.

Uğur Şahin, Özlem Türeci og Katalin Karikó anno 2022.
Demokratisering af adgangen til medicin
Katalin Karikó, Drew Weissman, Uğur Şahin og Özlem Türeci er i dag kendte navne i den videnskabelige verden og endda berømte i offentligheden. Alle fire har det til fælles, at forhindringer for deres karriere har været almindelige og endda en drivkraften, hvilket berømmelsen til gengæld aldrig har været.
"Af natur græder eller klager forskere ikke . De prøver og fortsætter bare. Og de prøver endnu mere, hvis den vision, de forfølger, tjener en større sag,” fortæller Özlem Türeci.
”Vi har lavet en mRNA-værktøjskasse og har lært, hvordan vi kan sende forskellige budskaber til immunsystemet ved hjælp af mRNA. Dette er kun en del. Den anden del er, hvilket indhold der skal kommunikeres, og det kræver dyb mekanistisk forståelse af de sygdomme, vi ønsker at bekæmpe,” forklarer Uğur Şahin.
”Mest af alt er jeg spændt på at deltage i det videre samarbejde med forskerkolleger for at udforske alt det andet, som mRNA-vacciner kan gøre. Vi arbejder på malariavacciner til mennesker i Afrika og på leptospirosevacciner til mennesker i Sydøstasien. Vi arbejder også på vacciner mod herpes, HIV og jordnøddeallergi. Ligesom arbejdet med COVID-19-vaccinerne sker forskningen gennem samarbejde, så det er utroligt mange dygtige mennesker, der står bag det her,” tilføjer Drew Weissman.
”Jeg er utrolig lykkelig for, at min forskning har været med til at stoppe en pandemi, men jeg vil gerne understrege, at mange forskere og tekniske eksperter har bidraget til mRNA-vaccinernes succes. I løbet af de sidste par årtier har de været med til at fremme den viden på forskellige områder, der dannede grundlaget for vores arbejde. Få forskere er så heldige at se folk drage fordel af deres forskning,” siger Katalin Karikó.
"Nogle af vores venner kalder os immun-ingeniører. Vi brugte årtier på grundforskning, og det er stadig kernen i vores arbejde. Vi tror på, at rejsen ikke er slut endnu. Det er kun begyndelsen på en ny æra inden for medicin,” tilføjer Özlem Türeci.
"Revolutionen inden for kunstig intelligens, automatisering og robotteknologi betyder, at personaliserede vacciner til flere typer af tumorer kan begynde at blive tilgængelige inden for år. Vi tror på, at mRNA kan demokratisere adgangen til medicin. Det fascinerer mig. Dette vil revolutionere kræftbehandlingen. Vi tror, at dette er muligt inden for de næste 5 år," afslutter Uğur Şahin med samme selvtillid og klarsyn, som han viste, da han i januar 2020 lancerede indsatsen for at udvikle COVID-19-vaccinen.
