De fleste forbinder naturen med smukke og velordnede systemer, men sådan er det langtfra altid. Et nyt banebrydende studie af en af de centrale regulatorer i menneskekroppen, væksthormonreceptoren, viser, at den har en så uordnet struktur, at forskere har svært ved at tro det. Studiets resultater åbner nye veje fremad mod den fulde forståelse af receptorens biologi, og på sigt kan det hjælpe til nye strategier i behandling af manglende højdevækst og hormonmangel.
Når man skal åbne en hoveddør, ser de fleste nok en simpel og veldefineret låsecylinder til at stikke nøglen ind i. Receptorer er cellernes døre – mellem det indre miljø i cellen og miljøet omkring. Dørene åbnes og lukkes alt afhængig af, hvad cellen og kroppen som helhed har brug for. Låsene, som skal åbne og lukke signaler og molekyler igennem, er dog ofte langt mere komplicerede og uordnede, end forskerne tidligere har troet. Da ubalancer i receptorerne kan have stor betydning for sundhed og sygdom, er receptorerne også centrale i lægemiddeludvikling.
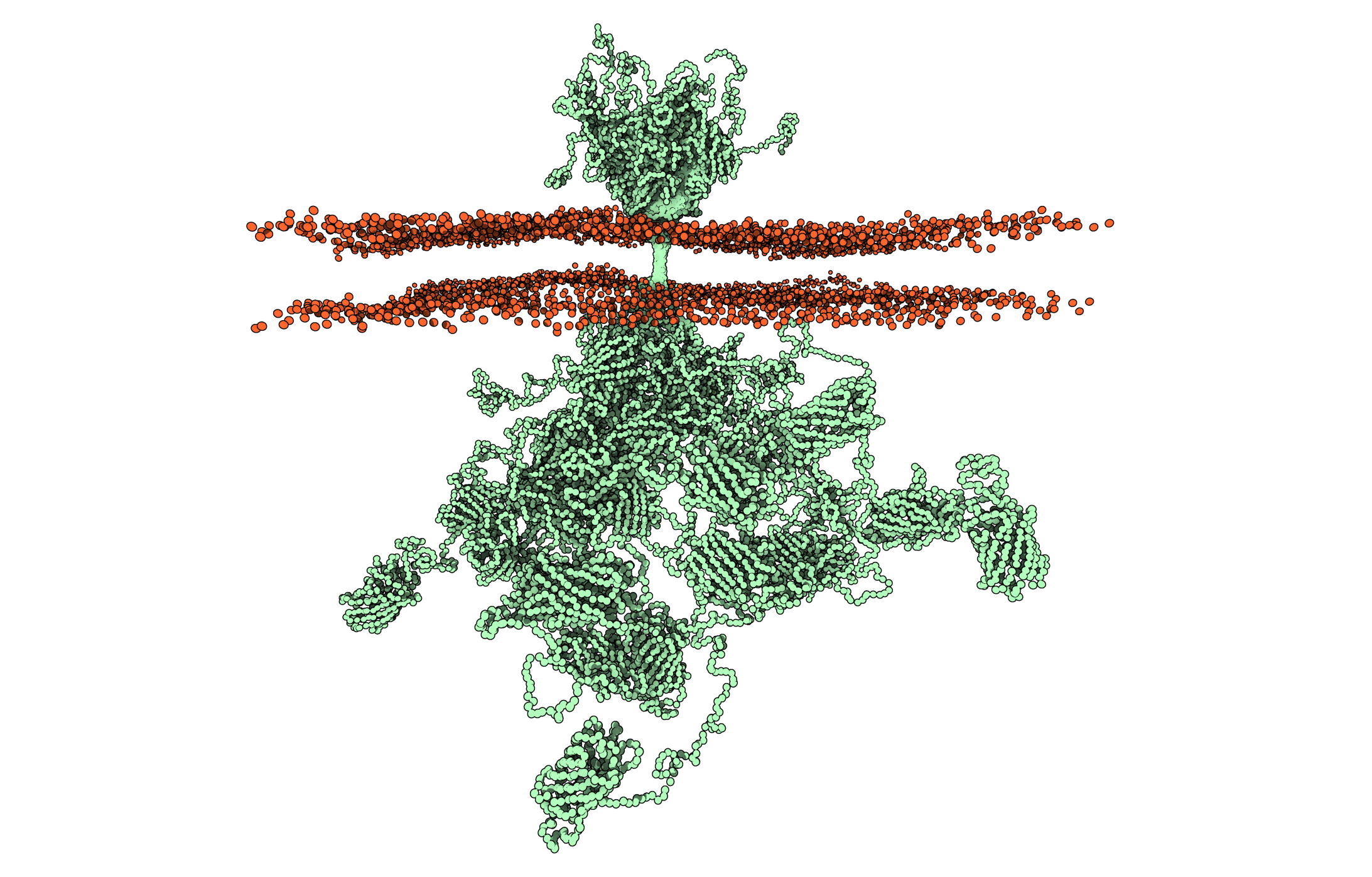
”På grund af sin lille størrelse og et stort strukturelt kaos umuliggør proteiner som den humane væksthormonreceptor brugen af de konventionelle metoder til at bestemme dens struktur, men det er endelig lykkedes os ved at kombinere metoder at bestemme den første struktur af denne type membranproteiner i fuld længde indlejret i en membran. Resultatet er bemærkelsesværdigt, for mens det ydre af låsen er velordnet, så er det indvendige et spaghettiagtigt kaos, som vi ikke forstår helt endnu, men som kan få stor betydning for den måde, vi forstår biologien, og derfor også hvordan vi behandler hormonforstyrrelser i fremtiden,” forklarer Birthe B. Kragelund, professor og centerleder i Novo Nordisk Fondens Challenge Center REPIN ved Biologisk Institut på Københavns Universitet.
Strukturbiologiens forældreløse proteiner
Studiet har fokus på væksthormonreceptoren ’Human growth hormone receptor’ (hGHR). Receptoren aktiveres i kroppen, når væksthormon binder sig til den, og når den tændes eller slukkes, har det stor betydning for en lang række processer fx vækst af muskler og knogler, stofskifte og ikke mindst i immunsystemet. Men selvom kunstigt væksthormon har været produceret i mere end 50 år, har det ikke før været muligt at finde ud af, hvordan receptoren i cellerne ser ud i fuld størrelse.
”Der findes et utal af krystalstrukturer i den del af receptoren, der findes uden for cellen – den del, som hormonet binder sig til. De strukturer er dog typisk af receptoren sammen med hormonet eller lignende stoffer, der binder til den. De strukturer har givet en meget vigtig viden om, hvordan væksthormon binder til sin receptor, og hvordan man har kunnet udvikle lægemidler, der forhindrer eller forstærker receptorens signaler. Faktum er dog, at det ydre jo kun løser halvdelen af gåden. Den anden halvdel findes nemlig indenfor membranen,” fortæller Birthe B. Kragelund.
Løsningen af strukturen af receptoren har – med et velordnet ydre domæne, en membranindlejret helix-struktur og et indre uordnet domæne uden struktur – været en stor metodologisk udfordring. På grund proteinets lille størrelse (70 kilodalton) og den store mængde strukturelt kaos i det meste af proteinet har det nemlig ikke været muligt med konventionelle metoder at bestemme strukturen – indtil nu.
”Med kortlægningen af det humane genom for ca. 20 år siden blev det tydeligt, at mere end 30 % af vores proteom er proteiner uden fast strukturel form, såkaldte ’intrinsically disordered proteins’. På grund af deres mange dynamiske former lader de her proteiner sig hverken krystallisere eller fotografere med elektronmikroskopi. Man har været metodemæssigt udfordret, og receptorer som væksthormonreceptoren har på den måde været forældreløse inden for den strukturelle biologi. For at opnå strukturer af disse proteiner og derved komme til at forstå dem bedre, har det krævet, at vi forskere har arbejdet stærkt integrativt – meget mere end hidtil,” siger Birthe B. Kragelund.
Et springbræt
Receptorer er generelt komplekse proteiner, og for at forstå deres fulde struktur har det derfor krævet et tværfagligt forskningssamarbejde, der forener 7 forskergrupper fra Danmark, Canada, Tyskland og Sverige, specialiseret i meget forskellige discipliner som gærekspression, massespektrometri, proteinkemi, biofysik, røntgenkrystallografi, molekyldynamik og modellering, NMR-spektroskopi samt neutron- og røntgensmåvinkelspredning. For første gang har man undersøgt den intakte receptor i dets omgivelser af en lipidmembran.
”For komplekse proteiner som GHR kan det slet ikke lade sig gøre at bestemme proteinets struktur med en enkelt af de klassiske eksperimentelle metoder som krystallografi, NMR eller cryo-EM. Kort fortalt så er GHR alt for fleksibelt til krystallografi og cryo-EM, mens det er alt for stort til en tilbundsgående NMR-analyse,” fortæller medforfatter Lise Arleth, professor i eksperimentel biofysik ved Niels Bohr Institutet ved Københavns Universitet og prodekan ved Det Natur- og Biovidenskabelige Fakultet.
”Neutron- og røntgensmåvinkelspredning kan håndtere hele proteinstrukturen og under tæt på naturlige forhold, men giver desværre langt mindre detaljeret information end de klassiske teknikker, så den teknik kan heller ikke stå alene,” forklarer Lise Arleth, og fortsætter:
”Vi har indtil nu anvendt en såkaldt ”del-og-hersk”-tilgang, hvor vi har studeret de enkelte domæner eller regioner hver for sig, hvorefter vi, som i et patchwork-tæppe, har stykket de enkelte bidder af information sammen til et samlet billede. Et af de vigtige gennembrud i dette arbejde var, at det lykkedes os at få stabiliseret GHR-molekylet i en såkaldt nanodisc, som indeholder en lille skive lipidmembran. Dermed kunne vi bruge småvinkelspredning til at se hele konturen af det samlede dynamiske molekyle, mens det sidder i membranen. Det gav os derefter en overordnet ramme, som vi ved hjælp fra molekyldynamik og proteinmodellering kunne pusle alle de øvrige bidder af eksperimentel information ind i.”
”Hver især gav de enkelte målinger ikke det fulde billede, men tilsammen gør de, at vi har skabt den første struktur nogensinde af et fuldlængdemembranprotein indlejret i et realistisk membranmiljø – indeholdende en stor uordnet kæde. Dette vil ikke kun være et springbræt for bedre at forstå den humane væksthormonreceptor. Det vil transformere, hvordan vi forestiller os de her uordnede proteiners biologi og cellulær signalering,” afrunder Birthe Kragelund.
Kaos er den ny normal
Det nye samarbejde viser altså, hvordan integrering af eksperimentelle data fra flere teknikker med computerberegninger sammen kan nå frem til strukturer af proteiner med lange, uordnede regioner – et udbredt fænomen i biologien. Omkring en femtedel af vores proteiner har både orden og uorden, og nogen har meget lange uordnede domæner.
”Det bliver tydeligt, at den del af receptoren udenfor cellen, som vi indtil nu har kigget på, egentlig bare et toppen af et kæmpe isbjerg. Når væksthormonet binder til væksthormonreceptoren aktiverer det nemlig en række forskellige intracellulære signaleringskaskader. Det, der foregår indenfor cellens vægge, som resultat af at hormonet binder til receptoren, har derimod været særdeles vanskeligt at finde frem til,” fortæller medforfatter på artiklen professor Kresten Lindorff-Larsen, leder af Lundbeckfondens BRAINSTRUC-initiativ for strukturel biologi og professor ved Linderstrøm-Lang Centret for Proteinvidenskab ved Biologisk Institut på Københavns Universitet.
Forskerne har nu for første gang et reelt billede af, hvordan receptoren ser ud – også indvendigt – men det giver jo selvfølgelig ophav til en række nye, interessante spørgsmål, og især den uordnede indre del udgør stadig lidt af en gåde.
”Vi er måske blevet forledt af, at de strukturer, man historisk først blev i stand til at bestemme eksperimentelt, var de mest velordnede. Måske er det uordnede – det tilsyneladende kaos – normalen,” funderer Kresten Lindorff-Larsen.
Stopklods i systemet
Det nye resultat er samtidig den første eksperimentelle model af gruppen af såkaldte cytokinreceptorer i fuld længde, mens den er indlejret i en membran. I de senere år har netop disse receptorer fået stor opmærksomhed, fordi en fysiologisk mangel på dem er sat i forbindelse med invaliderende immundefekter.
”Om væksthormonreceptoren er en repræsentativ model for hele denne gruppe af receptorer er dog endnu for tidligt at sige noget om. Vi er nødt til at forstå, hvordan den her simple binding af et stof på den velordnede yderside kan resultere i det korrekte signal på det spaghettiagtige kaos på indersiden af cellen viser. Det er stadig lidt af et enigma, hvordan bindingen af hormonet kan påvirke bevægelserne ned gennem membranen og måske forandre egenskaberne i den uordende del – altså hvordan kommunikation gennem uorden foregår – og det er vanvittigt interessant,” fortæller Birthe B. Kragelund.
Hvis forskerne lærer at forstå og sortere i kaosset og på den måde skelne ensemblet af signaler på indersiden, kan det til gengæld få meget stor betydning for behandlingen af sygdomme som fx forskellige cancerformer. På samme betydende måde som tilskud af væksthormon fik for vækst, som bl.a. den kendte fodboldspiller Lionel Messi fik som barn, ser man nu ind i en horisont, hvor man kan få mulighed for at afkode alle de andre funktioner, der varetages af receptoren. Med den nye viden kan der på sigt åbnes for helt nye strategier for behandling.
”Den typiske måde, hvorpå man behandlingsmæssigt har behandlet sygdomme har nemlig enten været at kaste en stopklods ind i systemet, sådan at receptoren umuligt kan danne sit signaleringskompleks, eller ved at give hormonet i tilskud for at aktivere receptoren. Nu har vi en meget bedre platform at stå på for at kunne studere de enkelte signalveje, og det vil det på sigt give mulighed for helt specifikt at tænde eller slukke for dem en ad gangen,” slutter Birthe B. Kragelund.
