Rejser i lav- og mellemindkomstlande fik den 20-årige Molly Stevens til at indse, hvor fuldstændig ulige verden er med hensyn til adgang til ressourcer og sundhedspleje. Det gav hende en drivkraft til at sikre, at hendes passion for videnskab skulle gøre en forskel i folks liv. Ved at designe nanomaterialer udvikler Molly Stevens og hendes team i dag avanceret lægemiddellevering, ultrafølsomme biosensorer og stilladser til vævsteknologi, så man kan genskabe øjne, knogler og hjerte. For sin banebrydende forskningsindsats inden for fremtidens medicin modtager hun Novo Nordisk Prisen 2023.
Op mod 3,5 milliarder mennesker – næsten halvdelen af verdens befolkning – mangler adgang til de sundhedstjenester, de har brug for. Ifølge WHO bliver næsten 100 millioner mennesker hvert år presset til ekstrem fattigdom på grund af udgifter til sundhedspleje. Allerede tidligt i sin karriere indså Novo Nordisk-prismodtageren Molly Stevens i 2023, at sundhedsinnovation og digitale teknologier er nogle af nøglerne til at løse denne ulighed.
”Jeg blev meget motiveret af at kunne arbejde med videnskab, der ikke kun skulle gavne rige mennesker, men også kunne hjælpe med at demokratisere adgangen til sundhedsvæsenet. Og dette er stadig en kæmpe motivator og hjælper os med at sætte mål inden for meget af det arbejde, vi udfører i mit team, såsom biosensor-systemer, der kan opdage HIV tidligere. Ved at skabe en grundlæggende forståelse af materialers grænseflader til biologi, sigter vi mod at udvikle teknologier, der kan revolutionere adgangen til sundhedspleje,” forklarer Molly M. Stevens, professor i biomedicinske materialer og regenerativ medicin fra Imperial College London, Storbritannien.
Fem år var for lang tid
For en udenforstående, der ikke kender Molly Stevens, ser det ud til, at hun laver mange forskellige ting, og hun indrømmer da også selv, at hun er "en af de mennesker", som altid har været interesseret i mange forskellige ting. I skolen elskede hun geografi, sprog og naturvidenskab. Men til sidst valgte hun naturvidenskaben og beholdt sin interesse for sprog og geografi som hobbyer. Det satte hende også i stand til at være kreativ.
”Jeg synes, videnskab er så kreativ. Folk, som mener, at den ikke er det, er misinformerede. Jeg ser mange paralleller mellem kreativitet i kunst og kreativitet i naturvidenskab. Jeg elsker at udsætte mig selv for masser af kunst og masser af musik, fordi det er en del af min næring til at holde et åbent sind. Men videnskaben er enormt kreativ. Jeg er et meget visuelt menneske, så meget af min kreative tænkning ligger i billeder og med fokus på, hvordan tingene hænger sammen i tre dimensioner.”
Molly Stevens valgte at studere til farmaceut på Bath University, Storbritannien, fordi det dækkede mange forskellige ting – fra menneskelig biologi over kemi og design af lægemidler til farmakologi – men ikke nødvendigvis fordi hun ønskede at blive farmaceut.
"Det er lidt ironisk, når jeg tænker over det nu. Jeg havde tænkt på at læse medicin. Og det besluttede jeg mig for ikke at gøre, fordi jeg syntes, at 5 år var for lang tid til at være på universitetet. Jeg har været der lige siden," smiler Molly.

Foto: Molly Stevens.
1.000 gange bedre
Bath University er kendt for skabe et unikt studiemiljø og for at give de studerende en enestående forberedelse til den virkelige verden. Da hun var færdiguddannet og efter at have arbejdet i et år på hospitaler, besluttede Molly Stevens at opdage den virkelige verden ved at tage sig tid til at rejse lang tid i Sydøstasien og Indien.
”Under mine rejser blev jeg meget opmærksom på, hvor enormt ulige vores verden er i menneskers adgang til ressourcer og sundhedspleje. Og det har lige siden rumsteret i mit baghoved, hvordan jeg kunne gøre en forskel på dette område.”
Tiden væk på rejsen fik hende også til at spekulere på, hvad det var for et ph.d.-studie hun ville lave.
»Jeg ville gerne have noget, jeg virkelig kunne fordybe mig i. Jeg besluttede, at jeg ville lave en ph.d., der skulle være så hård som muligt. Det var min primære motivation. Jeg valgte enkeltmolekyle-biofysik, fordi jeg ikke havde læst fysik på A-niveau. Og jeg syntes, det lød svært og som en god udfordring.”
I 3 år arbejdede Molly Stevens med atomic force microscopy – atomar kraftmikroskopi – en skanningsteknologi opfundet i 1985 af IBM-forskere. Metoden kan bruges til at indsamle information ved at skanne overfladen af en prøve med en mekanisk sonde, en såkaldt cantilever. Dette skaber en billedopløsning, der er mere end 1.000 gange bedre end den optiske diffraktionsgrænse , hvilket gør det muligt for forskere at studere objekter i størrelsesordenen brøkdele af en nanometer.
”Det var så spændende en tid, fordi det var den tid, hvor atomic force microscopy blev brugt for første gang til at afdække bindingen mellem enkelte molekyler. Og jeg fik brugt det til grundlæggende at forstå hvordan peptider – små proteinfragmenter – var bundet sammen, ved at måle kræfterne mellem dem på enkeltmolekyle-niveau. Jeg blev interesseret i at forstå, hvordan molekyler finder sammen, hvad der holder dem sammen, og hvordan kan vi studere dette og forstå det helt nede på nanoskala.”
Senere udvidede undersøgelserne af biologiske interaktioner sig til at undersøge protein-til-protein-interaktioner, og studierne skulle vise sig banebrydende på det tidspunkt, hvor atomic force microscopy dukkede op. I dag er det et af de førende værktøjer til billeddannelse, måling og manipulation af stof på nanoskala.
Fra et helt andet felt
Året 2000, hvor Molly Stevens afsluttede sit ph.d.-studie, var spækket med alle mulige kæmpestore konferencer om, hvad det nye årtusinde mon ville bringe. Hun deltog i en i San Francisco, hvor hun tilfældigvis gik forbi et lokale, hvor et billede fangede hendes opmærksomhed. På skærmen var en lille dreng med alvorlig leversvigt. Foredraget handlede om, hvordan man designer materialer, der kan hjælpe kroppen med at helbrede sig selv.
”Jeg syntes, det her bare var vidunderligt, og det inspirerede mig totalt – at ens forskning kunne have så stor indflydelse på at hjælpe mennesker. Dette var fuldstændig uventet, og inden for få minutter følte jeg mig sikker på, at det var det, mit næste projekt skulle være.”
Efter foredraget henvendte Molly sig til personen, der holdt foredraget, og spurgte ham, om hun kunne tage et postdoc-stipendium med ham – uvidende om, at det var den verdenskendte ingeniør Robert Langer.
”Jeg kom fra et helt andet felt. Så jeg var nok mindre nervøs for at tale med ham, end jeg ville have været, hvis jeg havde indset, hvor berømt han var, men jeg elskede bare hans tilgang og hans energi. Og jeg havde en vidunderlig tid i hans laboratorium. Jeg holdt fast i mine færdigheder, mens jeg lærte at anvende dem på en helt anden måde.”

Foto: Robert Langer.
Knoglebioreaktoren
De næste 3 år i Department of Chemical Engineering ved MIT i Cambridge udviklede Molly Stevens' færdigheder sig i en mere anvendt retning med et overordnet mål om at påvirke menneskers liv og kickstartede hendes karriere inden for et nyt felt.
”Jeg kom til at arbejde på et spændende projekt med Robert Langer og Prasad Shastri: the Bone Bioreactor. Det handlede om at dyrke knogler på ydersiden af eksisterende ben, så man bagefter kan transplantere dem til et andet sted på kroppen. Det virkede som et højrisikoprojekt. Men jeg var ikke så bekymret over det. Jeg tænkte, at der var en chance for succes. Og hvis det virkede, ville det være helt fantastisk.”
Knogler er generelt ret gode til at reparere sig selv i kroppen. For at hele komplekse knoglebrud er en knogletransplantation fra hoftekammen dog nødvendig for at erstatte manglende knogle, men det kan til gengæld medføre voldsomme smerter i hoftekammen år efter. Ideen med knoglebioreaktoren var derfor at igangsætte genereringen af nye knogler i kroppen.
”Vi har et lag af stamceller langs vores lange knogler, kaldet periosteum. Mit bidrag til dette var at udvikle væske, som vi kunne injicere under dette lag. Væsken bliver til en stiv gel, der ved indsprøjtning kunne skabe et kunstigt hulrum ved siden af knoglen, og det lykkedes. Stamcellerne vågner op, når du har et brud, og det lykkedes os at genskabe den samme effekt med væsken. Så vi var i stand til at generere enorme mængder af velorganiseret knogle til transplantation andre steder i kroppen.”
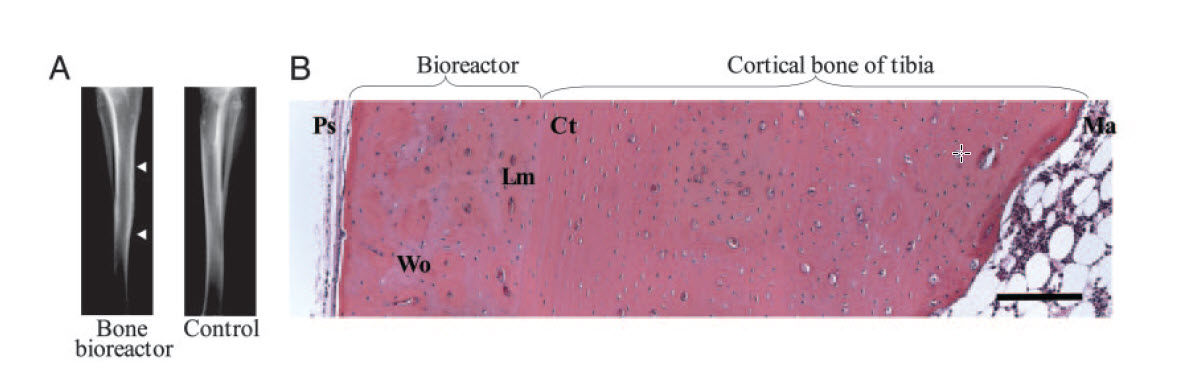
Foto: Forskerne var i stand til at generere enorme mængder af velorganiseret knogle til transplantation andre steder i kroppen.
En følelse af positiv energi
En simpel alginatgel, afledt af tang, dannede stilladset til knoglebioreaktoren. Molly Stevens' ophold på MIT skulle vise sig at skabe en væsentlig del af det afgørende fundament for hendes fremtidige karriere. Efter sin ph.d. i 2004 kom hun til Imperial College London, hvor hun derefter startede en meget tværfaglig forskergruppe.
”Teamet og dets følelse af positiv energi er nøglen til succes. Vores team har både biologer, ingeniører, fysikere, materialeforskere og kirurger. Det er fantastisk. For hvis du har et gruppemøde, kan du være utroligt innovativ og skyde en masse ideer rundt og samtidig krydre dem med en sund dosis realisme, fordi vi måske kan foreslå noget fra et ingeniørmæssigt synspunkt, men så kan det være, kirurgen pludselig siger, at sådan gør man ikke i praksis.”
Folk sagde ofte til Molly, at hun enten skulle fokusere på helt grundlæggende forskning eller meget anvendt forskning. Men hun nægtede at lytte, fordi det ikke gav mening.
”Fordi den indsigt, du får ved at forstå noget, for eksempel på nanoskala, kan bidrage direkte til at lave de bedste anvendte innovationer.”

Foto: Imperial College London
Indfanger graden af kompleksitet
Igen og igen i løbet af sin karriere er Molly Stevens vendt tilbage til udgangspunktet: at lære det grundlæggende gennem grundige analyser. En metode, der har bidt sig fast i hende, er Raman-spektroskopi – en kemisk analyseteknik baseret på lysets interaktion med de kemiske bindinger i et materiale. Teknikken er både ikke-destruktiv for levende materialer og leverer detaljeret information såsom krystallinitet, struktur og molekylære interaktioner og kan dermed være med til at give et biokemisk fingeraftryk af en levende celle.
"Jeg er interesseret i, hvordan celler interagerer med materialer: for eksempel for at hjælpe med vævsregenerering og organregenerering. Du kan designe nye materialer ved blot at efterligne de overordnede egenskaber af et eksisterende materiale, men det giver god mening også at tænke på og undersøge, hvad der sker helt nede på nanoskalaen eller på cellens niveau, så du kan genskabe materialer, som vil give det bedst mulige cellemiljø for at lave det bedst mulige væv."
Hvordan vævet beslutter, hvornår det skal dele sig, hvornår det skal specialisere sig, og hvornår det skal selvdestruere er igangværende processer i celler, men lige så vigtige for at regulere cellers skæbne er eksterne signaler fra den omgivende ekstracellulære matrix.
”Knogler er for eksempel smukt organiseret med masser af blodkar og en 3D-matrix af ligeligt organiserede nanofibre, der giver en masse information til cellerne – en ekstracellulær matrix, der er delvist organisk og delvist uorganisk. En central udfordring i vores arbejde har således været at fange den grad af kompleksitet, der er nødvendig for funktionelt at genskabe det naturlige væv så komplekst som knogler, brusk, hjerte og øjet."
I meget forskellige nye retninger
Mens nogle væv som knogle kan dyrkes in situ i en knoglebioreaktor, indså Molly Stevens hurtigt, at andre slags har brug for andre stilladser. Allerede i 2007 var hun med til at stifte en virksomhed, der udviklede platforme til at gro og reparere både blødt og hårdt væv baseret på hendes forskning, og hun fungerede som Chief Scientific Officer i virksomheden i 5 år sideløbende med sin akademiske stilling.
”Vi ønskede at have nok information til at få cellerne til at gøre, hvad vi vil, men ikke være så komplekse, at det ville gøre det for svært at komme til klinikken. Kun ved at forstå de grundlæggende begreber omkring materialer og grænsefladen til materialer, kan vi løse nogle af de centrale problemer. Og en ting, vi tænkte meget over på det tidspunkt, var at forsøge at forstå strukturen af vævet i kroppen.”
I 2008 blev Molly Stevens forfremmet til professor, hvilket gjorde hende til en af de yngste professorer i Imperial College Londons historie. Det anvendte arbejde, Molly lavede der i begyndelsen, var stadig inden for regenerativ medicin, der tog udgangspunkt i nogle af de ting, hun lærte under sin postdoc, men gik også i nye og meget anderledes retninger.
"For en udenforstående kan det se ud som om, vi laver mange forskellige ting: avanceret lægemiddellevering, ultrafølsomme biosensorer og stilladser til kunstigt væv. Men for mig er det en og samme ting: at designe materialer til at interagere på interessante måder med biologi. Og det er den slags centrale fundament for alle disse forskellige områder, hvor vi anvender vores indsigt.”
Celler i en tumor
Molly Stevens forestillede sig, hvordan arbejdet med materialer kunne føre til medicinske implantater konstrueret med nanoskalafunktioner for at muliggøre stærkere interaktion med værtsvævet i længere tid, men også hvordan nanostrukturerne kunne føre til både implanterede biosensorer og bioaktive kompositter til at levere lægemidler.
”En af vores store motivationer har været, at vi har brugt forskellige typer nanopartikler til lægemiddellevering eller fx på at lave nye og bedre vacciner. Vi har også arbejdet i samarbejde med Houston Methodist Research Institute på materialer, der minder lidt om nåle. Celler kan interagere med dem, og du kan få 50 eller flere af disse nåle pr. celle. Og hvad det kan gøre godt for, er at hjælpe med at levere ting ind i celler og væv, men også overvåge ting, der sker i disse celler eller væv.”
Forskerne viste, at arrays af biologisk nedbrydelige og biokompatible nåle kunne fremstilles ved hjælp af kemisk ætsning og standard mikrofabrikation. Nålene – lavet af mange forskellige materialer og kun nanometer i spidsen – kunne bruges til at levere nukleinsyrer såsom DNA eller proteiner til celler, men kunne også bruges til intracellulære sensorer til måling af biomarkører på en yderst effektiv og ikke-toksisk måde.
”Vi var interesserede i, hvordan vi måske kunne måle forskelle mellem kræftceller og raske celler. Vi ved, at der er mange forskelle i miljøet –i pH og i intracellulær enzymatisk aktivitet – især proteasen kaldet cathepsin B, som er opreguleret i kræftceller, og derfor funktionaliserede vi nålene med korte peptider, der havde en fluorofor på enden."
En fluorofor er en kemisk forbindelse, der kan genudsende lys, når den exciteres af lys. Når cathepsin B-proteasen i kræftcellerne spalter fluoroforen, lyser den op, hvilket gør det muligt for kirurger at identificere marginalceller i en tumor og fjerne den fuldstændigt med højere præcision. Forskerne har også været i stand til at bruge nanonålene til at levere kvanteprikker – nanokrystaller af et halvledende materiale – ind i cellerne.
”Vores gruppe var den første til at bruge disse kvanteprikker til at måle enzymaktiviteter som fx kinase- og acetyltransferaser, der er meget vigtige i forbindelse med de her sygdomme.”
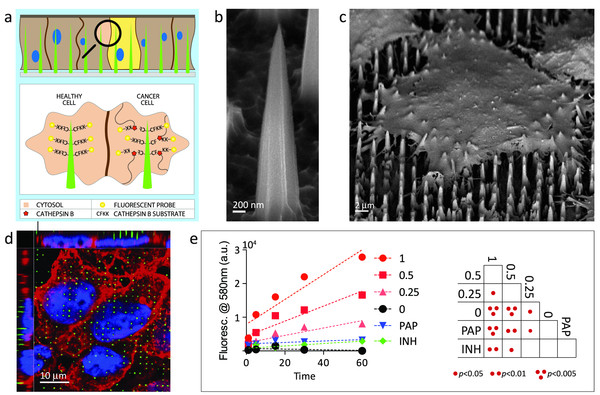
Foto: Med nålene – lavet af mange forskellige materialer og kun nanometer i spidsen kan forskerne måle forskel på raske celler og kræftceller.
At vende tingene på hovedet
Rejsen, som Molly Stevens' team har været på for at forstå grænsefladen mellem materialer og biologi, har ført til store fremskridt inden for både regenerativ medicin, og hvordan nanopartikler kan målrettes og levere bestemt medicin i kroppen. Sensorer til påvisning af sygdom er den tredje og lige så store del af forskningsporteføljen for Stevens Group på Imperial College London.
”Arbejdet har centrale oplagte anvendelser inden for infektionssygdomme, men også til at opdage tidlig hjertesvigt eller kræft. Alle disse sygdomme kan drage fordel af tidlig opdagelse, og det er det mål, der driver os. Hvordan kan vi bruge disse nanomaterialesystemer til at muliggøre bedre tidlig detektion, så vores patienter i sidste ende kan behandles bedre?”
Arbejdet fokuserer på at undgå et behov for komplekse og dyre instrumenter og i stedet designe og udvikle systemer, der kan aflæses med det blotte øje. I nogle af sine tidligere projekter introducerede Molly og hendes kolleger et system, der kunne detektere ultralave koncentrationer af prostata-specifikt antigen i serum.
For at kunne gøre det tog forskerne guldpartikler i nanometerstørrelse, der var forbundet via korte kæder af aminosyrer på deres overflade. Når nanopartiklerne samlede sig, dannede de en blå opløsning. Men når opløsningen indeholder det prostataspecifikke antigen – et enzym, der findes når man har prostatakræft – klippes forbindelsen i stykker, partiklerne adskilles, og opløsningen bliver rød. Og fordi hvert enzym kan skære igennem mange molekyler, forstærkes signalet igen. Denne måde at tænke nyt indenfor biosensorer er karakteristisk for Molly Stevens' forskning.
”Jeg tror, at mange af ideerne kommer af, at forskellige discipliner arbejder sammen. Grænsefladen mellem forskellige discipliner er en udfordrende ting, men den er så givende, fordi den på mange måder er mindre brugt end de enkelte discipliner hver for sig. Du kan have en masse kreativitet ved disse grænseflader.”
Et væld af applikationer
Opfindelsen af nye og til tider overraskende begreber er karakteristisk for Molly Stevens. Et nyligt eksempel på dette er hendes gruppes udnyttelse af opdriftsprincipper til at generere nye materialer med veldefinerede sammensætningsmæssige, mekaniske eller biokemiske gradienter.
”De væv og knogler, der udgør vores kroppe, er komplekse og dannet af en række forskellige komponenter. Replikation af disse materialer har derfor været kompliceret. Vi forsøgte derfor at udvikle en enkel, hurtig og alsidig måde at skabe dem på.”
Den målrettede udfordring var den osteochondrale grænseflade – regionen mellem brusk og knogle.
”Det er en ikke-homogen konstruktion med en naturlig gradient på tværs af flere materialer. Ved at sprøjte en væske ind i en anden og mere tæt væske var vi i stand til at producere en justerbar gradient blot ved at udnytte den grundlæggende kraft af opdrift. Vi kunne så bevare gradienterne gennem gelering og polymerisering.”
Mollys team gik endda endnu længere for at skabe gradienter med forskellige partikler og molekyler, og de var endda i stand til at fintune skarpe og gradiente overgange i materialet.
”Dette åbner muligheder for et væld af applikationer inden for fremstilling af materialer og vævsteknologier.”

Foto: Ved hjælp af opdrift kan forskerne skabe forskellige typer af væv.
Muliggør design af bedre lægemidler
En ting har dog indtil videre afholdt Molly Stevens' team fra at skabe de største revolutioner.
”En af vores store motivationer har været at bruge forskellige typer nanopartikler til at forsøge at lave nye og bedre terapier, men en frustration, vi havde, er manglen på teknikker, der kan hjælpe med at forstå nanopartikler på enkeltpartikelniveau.”
Især for nanopartikler kan heterogenitet i materialet påvirke funktion og anvendelighed markant, og konventionelle kemiske analyseteknikker findes kun til at analysere store mængder af nanopartikler.
"Uden mere grundlæggende forståelse er vi mere begrænsede i rationelt design, der kan hjælpe os med applikationer til alle mulige ting. Det, mit team har gjort, er at opfinde en teknik, der som den første i verden kan fange enkelte nanopartikler og måle deres kemi på en automatiseret måde.
Med SPARTA® (Single Particle Automated Raman Trapping Analysis) brugte holdet deres erfaring med at bruge Raman-baseret karakterisering til at udvikle en maskine, der automatisk kan fange partikler og analysere deres kemi for størrelse, sammensætning, reaktivitet og overflade.
"Det kan vise sig at have mange forskellige vigtige anvendelser. Du kan forstå, hvor meget stof der er inde i et materiale. Hvordan forbinder proteiner sig med nanopartiklernes skal? Og hvordan påvirker dette, hvordan en partikel bevæger sig i kroppen og kommer til de rigtige celler af interesse? Med vores teknologi kan du nu måle ændringer i realtid på en enkelt partikel, hvilket bare er helt utroligt."
SPARTA® hjælper allerede forskere med at studere andre biologiske systemer og nanobiosystemer.
”Det kan gøre dig i stand til at designe bedre medicin. Du kan overvåge kvaliteten af nanopartikelprodukter bedre, men du kan også lave forbedringer i designet.”
En drøm går i opfyldelse
Molly Stevens er netop blevet udnævnt til John Black Professorship between Medicine and Engineering ved University of Oxford og bliver vicedirektør for det nyetablerede tværfaglige Kavli Institute for NanoScience Discovery. Men selvom hendes karriere har været ekstremt vellykket, lurer én drøm stadig i baghovedet: drømmen, der oprindeligt skabte hendes ønske om at revolutionere den medicinske verden.
”Når man rejser, for eksempel i Afrika, ser man mange mennesker i vanskelige forhold. Vi er bare så privilegerede i de velstillede lande. Det har altid været meget motiverende for mig, og det har jeg altid i baghovedet. Min drøm er, at vores forskning kan hjælpe mennesker over hele verden."
På verdensplan forbliver mange infektioner udiagnosticerede og ubehandlede på grund af dårlige diagnostiske værktøjer, hvilket resulterer i vedvarende overførsel af alvorlige infektioner eller forsinkelser i at identificere nye trusler, hvilket fører til store konsekvenser for millioner af mennesker. For eksempel lever anslået 38 millioner mennesker i øjeblikket med HIV.
”De eksisterende tests påviste antistoffer mod HIV, hvilket betyder, at man skal vente uger, og det skyldes, at de test, der kunne bruges i marken til at påvise selve virussen, ikke var følsomme nok.”
Foto: Der lever anslået 38 millioner mennesker i øjeblikket med HIV.
Demokratisering af verdensomspændende adgang
For at løse dette transformerede forskerne de eksisterende lateral flow-assays, svarende til dem, man kender fra COVID-19-hurtigtests, til at registrere p24 – et protein, der findes på ydersiden af HIV-virussen. Ved at inkorporere internt designede katalytiske nanopartikler, der producerede en forstærkning, øgede de følsomheden op til 100 gange, hvilket muliggjorde detektion, selv når virusniveauet er meget lavt.
Planen er at distribuere og bruge testene i fjerntliggende egne; en plan, der udnytter den nuværende udvidelse inden for mobiltelefonteknologi med anslået 6 milliarder brugere på verdensplan.
”Mange vil have svært ved at komme til et sundhedscenter, men de vil kunne bruge en test, som kan aflæses på deres egen mobiltelefon. Ved at lave en test, der kan fungere i decentrale rammer, kan du få adgang til flere mennesker og igen være med til at demokratisere adgangen til sundhedsvæsenet.”
Molly Stevens mener, at det at have denne slags simple og robuste tests med ultrafølsom biosensing-evne kan hjælpe med at lette virkningerne af mange infektionssygdomme, der påvirker mennesker over hele verden, som det sås med COVID-19.
”Tidlig diagnose spiller en afgørende rolle i behandling, pleje og forebyggelse af infektionssygdomme, men især baseret på påvirkningen i lav- og mellemindkomstlande er der et stort behov for diagnostiske tests, der kan opdage sygdomme meget tidligere til en overkommelig pris. Mit håb er, at når dette lykkes, kan det endelig bane vejen for en demokratiseret verdensomspændende adgang til avancerede sundhedsteknologier."
